-

-
北京协和医院
-
三级甲等
北京协和医院是集医疗、教学、科研于一体的现代化综合三级甲等医院,是国家卫生健康委指定的全国疑难重症诊治指导中心,最早承担高干保健和外宾医疗任务的医院之一,也是高等医学教育和住院医师规范化培训国家 级
-
-

-
四川大学华西医院
-
三级甲等
锦江春色来天地,玉垒浮云变古今。在中国历史文化名城成都市锦江万里桥头的华西坝,有一座闻名遐迩的医学城,她就是四川大学华西临床医学院/华西医院。追溯历史,华西医院起源于美国、加拿大、英国等国基督教会1
-
-

-
中国人民解放军总医院
-
三级甲等
一、历史沿革中国人民解放军总医院前身是中国协和医学院第二临床学院,1953年10月,总后方勤务部卫生部决定将“中国协和医学院第二临床学院”改为“军委直属机关医院”。1954年7月,总后方勤务部
-
-

-
复旦大学附属中山医院
-
三级甲等
复旦大学附属中山医院是国家卫生健康委员会委属事业单位,是复旦大学附属综合性教学医院。医院开业于1937年,是中国人创建和管理的最早的大型综合性医院之一,隶属于国立上海医学院,为纪念中国民主革命的先驱孙
-
注射用卡瑞利珠单抗
通用名称:注射用卡瑞利珠单抗
批准文号:国药准字S20190027
生产企业: 江苏恒瑞医药股份有限公司
功能主治:1.本品用于至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤患者的治疗。本适应症是基于一项单臂临床试验的客观缓解率和缓解持续时间结果给予的附条件批准。本适应症的完全批准将取决于正在计划开展中的确证性随机对照临床试验能否证实卡瑞利珠单抗治疗相对于标准治疗的显著临床获益。2.本品用于既往接受过索拉非尼治疗和/或含奥沙利铂系统化疗的晚期肝细胞癌患者的治疗。本适应症是基于一项II期临床试验的客观缓解率和总生存期结果给予的附条件批准。本适应症的完全批准将取决于正在计划开展中的确证性随机对照临床试验能否证实卡瑞利珠单抗治疗相对于标准治疗的显著临床获益。3.本品联合培美曲塞和卡铂适用于表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性的、不可手术切除的局部晚期或转移性非鳞状非小细胞肺癌(NSCLC)的一线治疗。4.本品用于既往接受过一线化疗后疾病进展或不可耐受的局部晚期或转移性食管鳞癌患者的治疗。
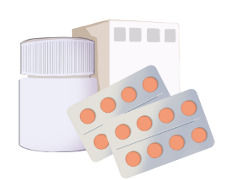
温馨提示:外观包装仅供参考;请按药品说明书或者在药师指导下购买和使用。
| 药品信息 | |||
| 主要成分 |
活性成份:卡瑞利珠单抗(人源化抗PD-1单克隆抗体)。辅料:α,α-二水合海藻糖、聚山梨酯20、冰醋酸、氢氧化钠和注射用水。 |
本品主要成份为多西份赛 化学名称名{2Ar-[2aα,4β,4aβ,6β,9α(αR*,Βs*),11α,12α,12aα,12bα]}-β-{[(1,1-二甲基乙氧基)羰基]氨基}-α-羟基苯丙酸[12b-乙酰氧苯甲酰氧-2a,3,4,4a,5,6,9,10,11,12,12a,12b-十二氢-4,6,11-三羟基-4a,8,13,13-四甲基-5-氧代-7,11-亚甲基-1H-环癸五烯并[3,4]苯并[1,2-b]氧杂丁环-9-基]酯。 分子式:C43H53NO14 分子量:807.88 |
|
| 生产企业 |
江苏恒瑞医药股份有限公司 |
齐鲁制药有限公司 |
|
| 批准文号 |
国药准字S20190027 |
国药准字H20031244 |
|
| 说明 | |||
| 作用与功效 |
1.本品用于至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤患者的治疗。本适应症是基于一项单臂临床试验的客观缓解率和缓解持续时间结果给予的附条件批准。本适应症的完全批准将取决于正在计划开展中的确证性随机对照临床试验能否证实卡瑞利珠单抗治疗相对于标准治疗的显著临床获益。2.本品用于既往接受过索拉非尼治疗和/或含奥沙利铂系统化疗的晚期肝细胞癌患者的治疗。本适应症是基于一项II期临床试验的客观缓解率和总生存期结果给予的附条件批准。本适应症的完全批准将取决于正在计划开展中的确证性随机对照临床试验能否证实卡瑞利珠单抗治疗相对于标准治疗的显著临床获益。3.本品联合培美曲塞和卡铂适用于表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性的、不可手术切除的局部晚期或转移性非鳞状非小细胞肺癌(NSCLC)的一线治疗。4.本品用于既往接受过一线化疗后疾病进展或不可耐受的局部晚期或转移性食管鳞癌患者的治疗。 |
1.适用于局部晚期或转移性乳腺癌的治疗。2.适用于局部晚期或转移性非小细胞肺癌的治疗,即使以顺铂为主的化疗失败后。 |
|
| 用法用量 |
本品须在有肿瘤治疗经验的医生指导下用药。推荐剂量• 经典型霍奇金淋巴瘤、食管鳞癌:200mg/次,静脉注射每2周1次,直至疾病进展或出现不可耐受的毒性。• 晚期肝细胞癌:3mg/kg,静脉注射每3周1次,直至疾病进展或出现不可耐受的毒性。• 晚期或转移性非鳞状非小细胞肺癌:200mg/次,静脉注射每3周1次,直至疾病进展或出现不可耐受的毒性。当卡瑞利珠单抗联合化疗给药时,应首先给予卡瑞利珠单抗静脉滴注,间隔至少30分钟后再给予化疗。另请参见化疗药物给药的处方信息。有可能观察到非典型反应(例如最初几个月内肿瘤暂时增大或出现新的小病灶,随后肿瘤缩小)。如果患者临床症状稳定或持续减轻,即使影像学有疾病进展的初步证据,基于总体临床获益的判断,可考虑继续应用本品治疗,直至证实疾病进展或出现不可耐受的毒性。特殊人群肝功能不全适用于非肝细胞癌患者:轻度肝功能不全患者无需进行剂量调整,中度或重度肝功能不全患者不推荐使用,没有对重度肝功能异常患者进行本品的相关研究。适用于肝细胞癌患者:轻度、中度肝功能不全患者无需调整剂量,没有对重度肝功能异常患者进行本品的相关研究。肾功能不全目前本品尚无针对中重度肾功能不全患者的研究数据,中度或重度肾功能不全患者不推荐使用。轻度肾功能不全患者应在医生指导下慎用本品,如需使用,无需进行剂量调整。儿童人群本品在18岁以下儿童和青少年人群中应用的安全性和有效性尚不明确。老年人群本品目前在>65岁的老年患者中应用数据有限,建议在医生的指导下慎用,如需使用,无需进行剂量调整。给药方法本品应由专业卫生人员进行给药操作,采用无菌技术进行复溶和稀释。输注宜在30-60分钟内完成。本品不得采用静脉内推注或快速静脉注射给药。使用、处理与处置的特别说明:本品不含防腐剂,配制时应注意采用无菌操作。每瓶注射用卡瑞利珠单抗应采用5mL灭菌注射用水复溶,复溶时应避免直接将灭菌注射用水滴撒于药粉表面,而应将其沿瓶壁缓慢加入,并缓慢涡旋使其溶解,静置至泡沫消退,切勿剧烈震荡西林瓶。复溶后药液应为无色或微黄色液体。如观察到可见颗粒,应丢弃药瓶。抽取5mL复溶后药液转移到含有100mL葡萄糖注射液(5%)或氯化钠注射液(0.9%)的输液袋中,并经由内置或外加一个无菌、无热原、低蛋白结合的0.2μm过滤器的输液管进行静脉输注。本品从冰箱取出后应立即复溶和稀释。稀释后药液在室温条件下,贮存不超过6小时(包含输注时间);在冷藏(2-8℃)条件下,贮存不超过24小时。如稀释后药液在冷藏条件下贮存,使用前应恢复至室温。本品不得由同一输液器与其他药物同时给药。本品仅供一次性使用,单次使用后剩余的药物必须丢弃。 |
多西他赛只能用于静脉滴注。所有病人在接受多西他赛治疗期前均必须口服糖皮质激素类,如地塞米松,在多西他赛滴注一天前服用,每天16mg,持续至少3天,以预防过敏反应和体液潴留。多西他赛的推荐剂量为70-75mg/m2,静脉滴注一小时,每三周一次。根据计算病人所用药量,用注射器吸取所需剂量,稀释到5%葡萄糖注射液或0.9%氯化钠注射液中,轻轻摇动,混合均匀,最终浓度不超过0.74mg/ml。 |
|
| 副作用 |
对本说明书【成份】项下的活性成份和辅料过敏反应的患者禁用。 |
1、对多西他赛或吐温-80有严重过敏史的病人;2、白细胞数目小于1500/mm3的病人;3、肝功能有严重损害的病人. |
|
| 禁忌 |
儿童注意事项: 尚未确立卡瑞利珠单抗在18岁以下儿童和青少年中的安全性与疗效。 妊娠与哺乳期注意事项: 妊娠期尚无妊娠女性使用本品的数据。动物研究已显示PD-1阻断性抗体具有胚胎胎儿毒性(参见【药理毒理】)。已知IgG可通过胎盘屏障,作为一种IgG4,本品可能会从母体扩散至发育中的胎儿。除非临床获益大于风险,不建议在妊娠期间使用本品治疗。哺乳期目前尚不清楚本品是否会经人乳分泌,以及本品对母乳喂养的婴幼儿及母乳产量的影响。由于人IgG会分泌到母乳中,本品对母乳喂养的婴幼儿可能存在潜在的风险,故建议哺乳期妇女在接受本品治疗期间及末次给药后至少2个月内停止哺乳。避孕育龄女性在接受本品治疗期间,以及最后一次用药后2个月内釆取有效避孕措施。生育力尚未进行卡瑞利珠单抗对两性生育力的研究,故本品对男性和女性生育力的影响不详。 老人注意事项: 本品目前临床试验中>65岁老年患者占所有患者数的13.6%。在1116例接受卡瑞利珠单抗单药治疗的患者中,>65岁老年患者占所有患者数的13.2%0老年患者与非老年患者所有级别的药物不良反应发生率分别为94.6%和94.0%,其中3级及以上的药物不良反应发生率分别为29.9%和29.4%,导致暂停给药的不良反应发生率分别为11.6%和15.4%,导致永久停药的不良反应为4.8%和5.7%。在205例接受卡瑞利珠单抗联合培美曲塞和卡钳治疗的患者中,>65岁老年患者占所有患者数的16.1%。老年患者与非老年患者所有级别的药物不良反应发生率分别为100.0%和99.4%,其中3级及以上的药物不良反应发生率分别为81.8%和66.3%,导致暂停给药的不良反应发生率分别为42.4%和37.2%,导致永久停药的不良反应为15.2%和13.4%。临床研究中没有对老年患者进行特殊剂量调整。由于目前临床试验中老年患者人数有限,建议老年患者应在医生指导下慎用,如需使用,无需进行剂量调整。 |
|
|
| 成分 |
1.本品用于至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤患者的治疗。本适应症是基于一项单臂临床试验的客观缓解率和缓解持续时间结果给予的附条件批准。本适应症的完全批准将取决于正在计划开展中的确证性随机对照临床试验能否证实卡瑞利珠单抗治疗相对于标准治疗的显著临床获益。2.本品用于既往接受过索拉非尼治疗和/或含奥沙利铂系统化疗的晚期肝细胞癌患者的治疗。本适应症是基于一项II期临床试验的客观缓解率和总生存期结果给予的附条件批准。本适应症的完全批准将取决于正在计划开展中的确证性随机对照临床试验能否证实卡瑞利珠单抗治疗相对于标准治疗的显著临床获益。3.本品联合培美曲塞和卡铂适用于表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性的、不可手术切除的局部晚期或转移性非鳞状非小细胞肺癌(NSCLC)的一线治疗。4.本品用于既往接受过一线化疗后疾病进展或不可耐受的局部晚期或转移性食管鳞癌患者的治疗。 |
1.适用于局部晚期或转移性乳腺癌的治疗。2.适用于局部晚期或转移性非小细胞肺癌的治疗,即使以顺铂为主的化疗失败后。 |
|
| 药理作用 |
药理作用T细胞表达的PD-1受体与其配体PD-L1和PD-L2结合,可以抑制T细胞增殖和细胞因子生成。部分肿瘤细胞的PD-1配体上调,通过这个通路信号传导可抑制激活的T细胞对肿瘤的免疫监视。注射用卡瑞利珠单抗是一种人类免疫球蛋白G4(IgG4)单克隆抗体(HuMAb),可与PD-1受体结合,阻断其与PD-L1和PD-L2之间的相互作用,阻断PD-1通路介导的免疫抑制反应,包括抗肿瘤免疫反应。在同源小鼠肿瘤模型中,阻断PD-1活性可抑制肿瘤生长。卡瑞利珠单抗在临床研究中可见皮肤毛细血管增生,但机制尚不清楚。非临床研究显示,卡瑞利珠单抗与人VEGFR2虽然具有弱结合,KD为714nM;卡瑞利珠单抗与药理作用靶点人PD-1结合的KD为3.31nM。毒性研究遗传毒性:尚未开展卡瑞利珠单抗遗传毒性研究。生殖毒性:尚未开展卡瑞利珠单抗生殖毒性研究。食蟹猴1个月和3个月重复给药毒性试验中,卡瑞利珠单抗对雄性和雌性生殖器官未见明显影响,但研究中的大部分动物尚未性成熟。通过保持母体对胎仔的免疫耐受来维持妊娠是PD-1/PD-L1通路的主要功能之一。阻断妊娠啮齿类动物模型的PD-L1信号通路可破坏母体对胎仔的耐受性,导致胎仔丢失增加。妊娠期间给予卡瑞利珠单抗有潜在的风险,包括流产或死胎的比例増加。基于卡瑞利珠单抗的作用机制,胎仔暴露于卡瑞利珠单抗可增加发生免疫介导紊乱或改变正常免疫应答的风险。致癌性:尚未开展卡瑞利珠单抗致癌性研究。其他毒性:文献资料显示,在动物模型中,抑制PD-1信号通路可增加一些感染的严重程度和增强炎症反应。与野生型小鼠相比,感染结核分枝杆菌的PD-1基因敲除小鼠存活率明显降低,这与PD-I基因敲除小鼠体内细菌增殖和炎症反应增加有关。PD-1基因敲除小鼠感染脑膜炎病毒后存活率同样降低。 |
药理作用:多西他赛为紫杉类药物,通过促进微管双聚体装配成微管,同时通过防止去多聚化过程而使微管稳定,阻滞细胞于G2和M期,从而抑制癌细胞的有丝分裂和增殖。多西他赛的药理作用比紫杉醇强,在细胞内浓度比紫杉醇高3倍,并在细胞内滞留时间长,其对微管亲和力是紫杉醇的2倍;作为微管稳定剂和装配促进剂,活性比紫杉醇大2倍;作为微管解聚抑制剂,活性比紫杉醇大2倍。在体外抗瘤活性试验中,已证实多西他赛的抗瘤活性是紫杉醇的1.3~12倍。临床研究表明,对于蒽环类耐药乳腺癌,多西他赛较紫杉醇有更高的有效率。多西他赛是目前为止蒽环类耐药乳腺癌的二线治疗中最有效的药物;在非小细胞肺癌单药治疗和联合化疗中,多西他赛是最有效的药物之一。遗传毒性:在CHO-K1细胞染色体畸变试验和小鼠骨髓微核试验中,多西他赛表现出致断裂作用,但在Ames试验和CHO/HGPRT基因突变试验中未见致突变作用。生殖毒性:在大鼠静脉注射多西他赛0.3mg/kg(按体表面积折算,约为临床推荐剂量的1/50),未见对生育力的损伤,但可引起睾丸重量减轻。该结果与大鼠和犬10个周期(每21天给药1次,连续6个月)的重复给药试验结果有相关性;大鼠和犬静脉注射剂量分别为5mg/kg和0.375mg/kg时(按体表面积折算,分别约相当于临床推荐剂量的1/3和1/15),可见睾丸萎缩和变性,大鼠在低剂量时增加给药次数也表现出相似的作用。怀孕时使用多西他赛可导致胎儿损伤。大鼠和家兔在器官形成期分别给予多西他赛≥0.3mg/kg/日和0.03mg/kg/日(按体表面积折算,分别相当于临床日推荐剂量的1/50和1/300),可见胚胎毒性和胎仔毒性(表现为子宫内死亡、吸收胎增加、胎仔体重减轻和骨化延迟)。以上剂量亦可引起母体毒性。目前尚无足够的和严格控制的孕妇临床研究资料。如果患者在孕期使用本品,或在使用本品期间怀孕,应被告之对胎儿的潜在危害和流产的潜在危险。有生育可能的妇女在使用本品治疗期间应避免怀孕。尚不清楚多西他赛是否从人乳中排泄。鉴于许多药物都可从人乳中排泄,且多西他赛可能引起哺乳婴儿的严重不良反应,母亲在使用本品前应停止哺乳。 |
|
| 注意事项 |
1. 应在专业医生指导下使用;2. 过敏体质者慎用;3. 孕妇及哺乳期妇女慎用;4. 定期监测肝肾功能;5. 出现严重不良反应应立即停药并就医。 |
1、多西他赛必须在有癌症化疗药物应用经验的医生指导下使用。由于可能发生较严重的过敏反应,应具备相应的急救设施,注射期间建议密切监测主要功能指标。2、在肝功能异常患者、使用本品高剂量治疗患者和既往接受铂类药物治疗的非小细胞肺癌患者,使用多西他赛剂量达10mg/m2时,与治疗相关的死亡的发生率会增加。3、所有病人在接受多西他赛治闻前需预服药物以减轻体液潴留的发生,预服药物只包括糖皮质激素类,如地塞米松,在多西他赛注射头一天开始服用,每天16mg,服用4-5天。4、中生粒细胞减少是最常见的不良反应,多西他赛治疗期间应经常对血细胞数目进行监测。当病人中性粒细胞数目恢复至1500/mm3以上时才能接受多西他赛的治疗。多西他赛治疗期间如发生严重的中性粒细胞减少(500/mm3并持续7天或7天以上,在下一个疗程中建议减低剂量,如仍有相同问题发生,则建议再减低剂量或停止治疗。5、在多西他赛开始滴注的最初几分钟内有可能发生过敏反应。如果发生的过敏反应的症状轻微如脸红或局部皮肤反应不需终止治疗。如果发生严重过敏反应,如血压下降超过20mmHg,支气管痉挛或全身皮疹/红斑,则需立即停止滴注并进行对症治疗。对已恨生严重不良反应的病人不能再次应用多西他赛。6、多西他赛治疗期间可能发生外周神经毒性反应。如果反应严重,则建议在下一疗程中减低剂量。7、已观察到的皮肤反应有肢端(手心或足底)局限性红斑伴水肿、脱皮等。此类毒性可能导致终断或停止治疗。8、肝功能有损害的病人:如果血清转氨酶(ALT和、或AST)超过正常值上限1.5倍,同时伴有碱性磷酸酶超过正常值上限2.5倍,存在发生严重不良反应的高度危险,如毒性死亡,包括致死的脓毒症、胃肠道出血以及发热性中性粒细胞减少症、感染、血小板减少症、口炎和乏力。因此,这些病人不应使用,并且在基线和每个化疗周期要检测肝功能。9、本品为细胞毒类药物,药物配制要注意安全防护。10、本品中已经含有乙醇,因此在配置药液时,可直接加入250m1的5%的葡萄糖溶液或0.9%的生理盐水注射液。无需先用乙醇水溶液稀释。本品一经配置,应立即使用。 |
|
药品查询
最新资讯
更多热门药品
更多-

枸橼酸西地那非片
西地那非适用于治疗勃起功能障碍。
-

盐酸非索非那定片
1.季节性过敏性鼻炎适用于缓解成人和6岁及6岁以上年龄儿童的季节性过敏性鼻炎相关的症状,如打喷嚏,流鼻涕,鼻、腭、喉部发痒、眼睛发痒、潮湿、发红。 2.慢性特发性荨麻疹适用于治疗成人和6岁及6岁以上年龄儿童的慢性特发性荨麻疹的皮肤症状,能够显著减轻瘙痒和风团的数量。
-

感冒灵胶囊
解热镇痛。用于感冒引起的头痛,发热,鼻塞,流涕,咽痛。
-

连花清瘟颗粒
清瘟解毒,宣肺泄热。用于治疗流行性感冒属热毒袭肺证,症见:发热或高热恶寒,肌肉酸痛,鼻塞流涕,咳嗽,头痛,咽干咽痛,舌偏红,苔黄或黄腻。
-

参苓白术胶囊
健脾,益气。用于体倦乏力,食少便溏。
-

远红外消炎止痛贴
适用于促进局部血液循环、辅助消炎、消肿和止痛。适用于对颈椎病、肩周炎、骨质增生、腰椎间盘突出、关节炎、肌纤维炎、软组织扭挫伤、急性腰肌劳损的辅助治疗。适用于缓解腿部关节、肌肉疼痛及肱骨外上髁炎引起的关节滑膜炎所致之疼痛。
-

加味藿香正气丸
解表化湿,理气和中。本品用于外感风寒,内伤湿滞,头痛昏重,胸膈痞闷,脘腹胀痛,呕吐泄泻。
-

依折麦布片
1.原发性高胆固醇血症本品作为饮食控制以外的辅助治疗,可单独或与HMG-CoA还原酶抑制(他汀类)联合应用于治疗原发性(杂合子家族性或非家族性)高胆固醇血症,可降低总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、载脂蛋白B(ApoB)。 2.纯合子家族性高胆固醇血症(HoFH)本品与他汀类联合应用,可作为其他降脂治疗的辅助疗法(如LDL-C血浆分离置换法),或在其他降脂治疗无效时用于降低HoFH患者的TC和LDL-C水平。 3.纯合子谷甾醇血症(或植物甾醇血症)本品作为饮食控制以外的辅助治疗,用于降低纯合子家族性谷甾醇血症患者的谷甾醇和植物甾醇水平。
-

氯雷他定颗粒
用于治疗季节性过敏性鼻炎(减轻鼻部或非鼻部症状)及特发性荨麻疹。
-

咳特灵胶囊
镇咳,祛痰,平喘,消炎。用于咳喘及慢性支气管炎咳嗽。
药企推荐
更多-

广东罗浮山国药股份有限公司
广东罗浮山国药股份有限公司是一家从事药品生产,药品经营,中草药收购等业务的公司,成立于2008年12月24日,公司坐落在广东省,详细地址为:惠州市博罗县长宁镇广汕公路边岭排工业区(罗浮山药业城);经国
-

北京韩美药品有限公司
北京韩美药品有限公司(以下简称北京韩美)成立于1996年3月,公司产品业务涉及儿科产品、消化科产品、骨科产品、抗感染药等领域,98%的产品在国内成产,主要产品有妈咪爱、易坦静、易安平、美常安、利动、
-

博福-益普生(天津)制药有限公司
益普生集团作为一家有着八十多年制药经验的欧洲制药集团,拥有20余种上市产品及遍布全球近4000名的员工。公司的发展战略是以三大治疗领域内的高科技产品为基础,即肿瘤、内分泌、神经肌肉类疾病,这些高
-

北京同仁堂股份有限公司同仁堂制药厂
北京同仁堂股份有限公司同仁堂制药厂成立于1990年11月21日,注册地位于北京市大兴区中关村科技园区大兴生物医药产业基地天贵大街33号,法定代表人为张朝华。经营范围包括加工、制造中成药;出租办公用房
-

辉瑞制药有限公司
辉瑞在中国业务覆盖全国300余个城市,并在华上市了五大领域的高品质的创新药物,包括肿瘤、疫苗、抗感染、炎症与免疫、罕见病等多个领域的处方药和疫苗。多年来,辉瑞始终致力于“成为中国医疗卫生体系重要组成
-

石家庄以岭药业股份有限公司
石家庄以岭药业股份有限公司于1992年6月16日创建,公司以“继承创新、造福人类”为企业宗旨,以“科技健康明天”为企业发展目标,以健康人类为己任,造福社会为弘愿,始终坚持市场龙头、科技驱动的创新发展
-

北京同仁堂科技发展股份有限公司制药厂
北京同仁堂科技发展股份有限公司制药厂成立于1980年07月31日,注册地位于北京市丰台区南三环中路20号,法定代表人为王煜炜。经营范围包括制造胶剂、口服液、丸剂、颗粒剂、糖浆剂、擦剂、气雾剂、软胶囊
-

海南碧凯药业有限公司
海南碧凯药业有限公司成立于1993年。是【国家高新技术企业】、国家工商总局【守合同重信誉单位】、海口工业【十佳企业】。拥有各类人才,员工近2000人。生产基地位于海口药谷,占地134亩,建筑面积10